Joule-Thomson-Effekt
Der Joule-Thomson-Effekt beschreibt die Temperaturänderung eines Gases bei der Entspannung, d. h. bei einer Druckminderung an einer Drossel. Der Effekt ist einer der Ursachen für eine Atemreglervereisung bei Tauchgängen in kalten Gewässern.
Wissen für fortgeschrittene Taucher (ED**)
Wird Gas an einer Drossel entspannt, d. h. der Gasdruck veringert, ändert sich die Gastemperatur. Ob sich das Gas abkühlt oder erwärmt und wie hoch die Temperaturänderung ist, hängt vom Ausgangsdruck bzw. der Druckdifferenz, der Menge des entspannten Gases und der Gasart ab.
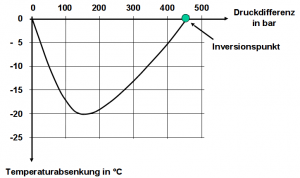
Wäre die Luft in der Druckluftflasche auf über 500 bar komprimiert, würde sich die abströmende Luft erwärmen. Bei einer Druckdifferenz von 450 bar würde die Temperatur gleich bleiben (Inversionspunkt) und erst bei geringerem Druck kühlt sie sich ab. Das Maximum der Abkühlung liegt bei etwa 160 bar bis 180 bar. Bei geringerer Druckdifferenz verringert sie sich wieder (siehe Abbildung rechts).
Man vermutet einen Zusammenhang bei tödlichen Tauchunfällen in den ersten 7 bis 10 Minuten: In diesem Zeitraum taucht man meist auf die größte Tiefe ab, man benötigt viel Gas für die Tarierung und man verbraucht wegen der Tiefe eine große Luftmenge bei der Atmung. Zusätzlich liegt der Flaschendruck in diesem Zeitraum in dem Bereich, bei dem die stärkste Abkühlung an den Ventilen durch den Joule-Thomson-Effekt auftritt. Durch die Kombination dessen kann es sehr leicht zu einer Atemreglervereisung kommen.
Der Joule-Thomson-Effekt hängt auch von der Gasart ab: Helium würde sich bei der Entspannung erwärmen. Beim Tauchen mit Trimix kann es daher auch bei extremem Gasverbrauch nicht zu einer Vereisung kommen.
Expertenwissen (DM***)
Die Ursache des Joule-Thomson-Effekts liegt in der Wechselwirkung der Gasteilchen miteinander. Beim Modell des idealen Gases exisitieren diese intermolekularen Kräfte nicht. In einem realen Gas sind sie allerdings vorhanden:
Die Gasteilchen ziehen sich bei größerem Abstand zueinander, d. h. bei geringem Ausgangsdruck, durch die sog. Van-der-Waals-Kräfte an. Um den Teilchenabstand zu vergrößern, d. h. bei einer Druckverminderung, muss deshalb Energie aufgebracht werden. Die Energie wird den Gasteilchen selbst entzogen und das Gas kühlt dadurch ab.
Bei geringem Abstand zueinander, d. h. bei hohem Ausgangsdruck, stoßen sich die Teilchen ab. Vergrößert sich bei einer Druckminderung der Abstand, wird Energie frei, wodurch sich das Gas erwärmt. Das Verhältnis der beiden Effekte hängt von der Temperatur, der Gasart und vom Ausgangsdruck ab und bestimmt, ob sich das Gas bei einer Entspannung abkühlt oder erwärmt.