Gesetz von Boyle-Mariotte
Das Gesetz von Boyle-Mariotte beschreibt den Zusammenhang zwischen Druck und Volumen einer abgeschlossenen Gasmenge bei konstanter Temperatur. Es ist das für den Tauchsport wichtigste physikalische Gesetz.
Inhaltsverzeichnis
Grundwissen für Open Water Diver* (OWD*)
Komprimierbarkeit von Gasen und Flüssigkeiten
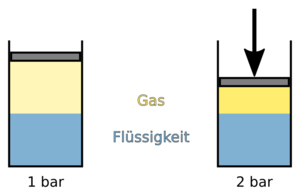
Gase sind im Gegensatz zu Flüssigkeiten komprimierbar. Wenn man den Druck einer abgeschlossenen Gasmenge erhöht, dann nimmt ihr Volumen ab. Du kannst dir das anhand folgendem Beispiels veranschaulichen:
Fülle eine Einmalspritze halb mit Wasser und halb mit Luft. Verschließe die Einlassöffnung mit einem Finger und drücke dann den Kolben hinein. Du wirst einerseits feststellen, dass sich das Volumen des Wassers nicht ändert, wohingegen das Volumen der Luft geringer wird. Gas lässt sich also komprimieren. Andererseits wirst du, um das Einlassröhrchen dicht zu halten, umso mehr Kraft benötigen, je weiter du den Kolben hineindrückst. Das bedeutet, dass du durch die Verkleinerung des Gasvolumens den Gasdruck erhöht hast.
Zusammenhang Druck - Volumen
Im Umkehrschluss, kann eine bestimmte Gasmenge, je nachdem unter welchen Druck sie steht, unterschiedliche Volumina einnehmen. Das Produkt aus Druck und Volumen entspricht der Gasmenge und bleibt natürlich bei unveränderter Gasmenge immer konstant. In Zahlen ausgedrückt hat ein feste Gasmenge bei doppeltem Druck das halbe Volumen, bei dreifachem Druck ein Drittel des Volumens, usw.
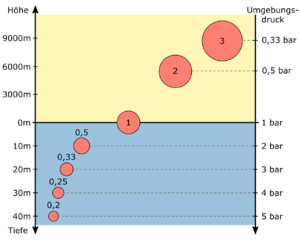
Der Luftballon in der Abbildung rechts hat an der Wasseroberfläche bei einem Umgebungsdruck von 1 bar ein Volumen von 1 l. Tauchst du mit ihm auf 30 m Tiefe ab, wird er durch den Umgebungsdruck von 4 bar auf ein Volumen von 0,25 l komprimiert. Der Druck in seinem Inneren beträgt dann ebenfalls 4 bar. Bringst du ihn hingegen auf einen hohen Berg, auf dem ein Umgebungsdruck von 0,5 bar herrscht, wird er auf ein Volumen von 2 l ausgedehnt. Dadurch verändert sich allerdings die Gasmenge in seinem Inneren − das Produkt aus Druck und Volumen − nicht.
Beispiele
Für dich als Taucher ist dieser Zusammenhang, der durch das Gesetz von Boyle-Mariotte beschrieben wird, in vielerlei Hinsicht sehr entscheidend:
- Deine Druckluftflasche hat ein festes Volumen (z. B. 10 l) und ist mit Luft, die unter hohem Druck (z. B. 200 bar) steht, gefüllt. Diese Luftmenge würde an der Wasseroberfläche bei 1 bar Umgebungsdruck das 200-fache Volumen einnehmen, also 2000 l entsprechen.
- Um unter Wasser überhaupt atmen zu können, muss deine Atemluft unter dem in deiner Tauchtiefe herrschenden Umgebungsdruck stehen. Da du bei jedem Atemzug - unabhängig von der Tauchtiefe - annähernd das gleiche Volumen einatmest, benötigst du beispielsweise in 10 m Tiefe die doppelte Menge und in 20 m Tiefe die dreifache Menge an Luft im Vergleich zur Wasseroberfläche. Das bedeutet, dass die Luftmenge, die du verbrauchst, stark von der Tauchtiefe abhängt.
- Würdest du auf Tiefe einen Atemzug nehmen, die Luft anhalten und dann auftauchen, dann würde sich währenddessen die Luft in deiner Lunge ausdehnen, da der Umgebungsdruck abnimmt. Das würde deine Lunge - genausowenig wie ein Luftballon, den man zu stark aufpumpt - nicht aushalten und du würdest ein Lungenbarotrauma erleiden. Deshalb darfst du unter Wasser niemals die Luft anhalten!
- In deinem Körper befinden sich viele weitere luftgefüllte Hohlräume, z. B. die Nasennebenhöhlen oder das Mittelohr, die über Kanäle (sog. Tuben) mit dem Nasen-Rachen-Raum verbunden sind. Die Luft in diesen Hohlräumen dehnt sich bei Auftauchen aus bzw. wird bei Abtauchen komprimiert. Sind die Kanäle beispielsweise durch eine Erkältung verschwollen oder blockiert, ist ein Druckausgleich nicht möglich und du erleidest Schäden an den Schleimhäuten in den Höhlen, am Trommelfell oder im Innenohr. Tauche deshalb nie bei Anzeichen einer Erkältung und teile deinem VIT-Tauchlehrer sofort mit, wenn du unter Wasser Schmerzen hast, damit er den Tauchgang mit dir sicher beenden kann.
- Auch bei der Tarierung begegnet dir das Gesetz von Boyle-Mariotte: Dein Auftrieb unter Wasser wird durch das Volumen der Luft in deinem Tarierjacket bestimmt. Beim Abtauchen erhöht sich der Umgebungsdruck, die Luft wird komprimiert, ihr Volumen nimmt ab und du hast weniger Auftrieb, d. h. du sinkst schneller ab. Deshalb musst du während des Sinkens immer wieder Luft in dein Tarierjacket geben um den zusätzlich entstandenen Abtrieb auszugleichen. Umgekehrtes gilt beim Auftauchen: Du musst während des Steigens immer wieder Luft ablassen, um nicht zu schnell zu werden.
Wissen für fortgeschrittene Taucher (ED**)
Berechnungen
Das Gesetz von Boyle-Mariotte besagt, dass das Produkt aus Druck und Volumen einer festen Gasmenge konstant bleibt. Wenn [math]p_1[/math] und [math]V_1[/math] Druck bzw. Volumen vor einer Druckänderung und [math]p_2[/math] und [math]V_2[/math] Druck bzw. Volumen nachher sind, dann lässt sich das Gesetz von Boyle-Mariotte mit folgender Gleichung ausdrücken:
- [math]p_1 \cdot V_1 = p_2 \cdot V_2[/math]
Um austariert zu sein, musst du auf 10 m Tiefe dein Jacket beispielsweise mit 5 l Luft befüllen. Die enthaltene Gasmenge beträgt somit:
- [math]p_1 \cdot V_1 = 2\ \text{bar} \cdot 5\ \text{l} = 10\ \text{barl}[/math]
Tauchst du auf 15 m Tiefe ab, ohne diese Gasmenge in deinem Jacket zu verändern, so verringert sich das Volumen, da der Druck zunimmt. Das Volumen [math]V_2[/math] kannst du berechnen, indem du oben stehende Gleichung umformst (durch [math]p_2[/math] dividierst) und die entsprechenden Werte einsetzt:
- [math]V_2 = \frac{p_1 \cdot V_1}{p_2} = \frac{10\ \text{barl}}{2,5\ \text{bar}} = 4\ \text{l}[/math]
Somit hast du je nach Dichte des Wassers etwa 1 kg weniger Auftrieb und sinkst weiter ab, wenn du keine Luft über deinen Inflator nachfüllst.
Wenn du auf 20 m Tiefe deine Lunge, die beispielsweise ein Volumen von 4 l hat, komplett mit Luft füllst, dann enthält sie eine Gasmenge von 12 barl:
- [math]p_1 \cdot V_1 = 3\ \text{bar} \cdot 4\ \text{l} = 12\ \text{barl}[/math]
Würdest du ohne auszuatmen zur Wasseroberfläche auftauchen, dann würde sich die Luft in deiner Lunge aufgrund des sinkenden Umgebungsdrucks ausdehnen:
- [math]V_2 = \frac{p_1 \cdot V_1}{p_2} = \frac{12\ \text{barl}}{1\ \text{bar}} = 12\ \text{l}[/math]
Dies würde die Dehnbarkeit deiner Alveolen bei weitem übersteigen und du würdest ein Lungenbarotrauma erleiden.
Expertenwissen (DM***)
Ideales Gas
Bei den obigen Ausführungen wurde ein sog. ideales Gas zugrunde gelegt, d. h. dass die Gasmoleküle kein Volumen haben und sich nicht gegenseitig beeinflussen. Das Gesetz von Boyle-Mariotte ist ein Spezialfall der Grundgleichung des idealen Gases:
- [math]\frac{p \cdot V}{T} = N \cdot k_B[/math]
Bei einer abgeschlossenen Gasmenge bleibt die Teilchenzahl [math]N[/math] konstant. Hält man weiterhin die Temperatur der Gasmenge bei einer Druck- bzw. Volumenänderung konstant, so ergibt sich daraus das Gesetz von Boyle-Mariotte:
- [math]p \cdot V = \text{konstant}[/math]
Reales Gas
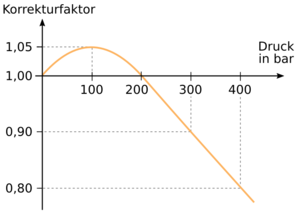
Bei höheren Drücken (z. B. 300 bar) gelten die Annahmen des idealen Gases nicht mehr, da die zwischenmolekularen Kräfte (Van-der-Waals-Kräfte) bei einer derart hohen Gasdichte nicht mehr zu vernachlässigen sind. Man muss somit Annahmen für ein reales Gas zugrunde legen.
Hier gilt der Zusammenhang Druck mal Volumen ist konstant des Boyle-Mariottschen Gesetzes nicht mehr exakt und es muss, um die Gasmenge aus (Flaschen-)Druck und (Flaschen-)Volumen zu bestimmen, ein Korrekturfaktor berücksichtigt werden.
Beispielsweise ist in einer mit 300 bar gefüllten 10 l-Flasche nur einen Gasmenge von 2700 bar l enthalten. Der Korrekturfaktor bei 300 bar beträgt gemäß der Abbildung 0,9.
Im Druckbereich bis 200 bar müsste eigentlich auch ein Korrekturfaktor berücksichtigt werden. Die Näherung ohne Korrekturfaktor ist allerdings für den Sporttauchbereich ausreichend, da die tatsächlich vorhandene Gasmenge je nach Druck etwas größer sein kann, als sie mit der Näherung berechnet wurde.